女,25岁,体检查体发现左乳肿块,当时无局部红肿疼痛,无乳头溢血溢液,患者未予重视,未行相关治疗。
病案讨论
钼靶结论:
1.左乳晕后肿块,建议MR增强检查及穿刺活检,BI-RADS 4C。
2.双乳腺体增生伴部分结节状改变,BI-RADS 2。
3.双侧腋下淋巴结及右侧副乳。
MR:腺体类型:呈不均匀致密型(ACR-c);
背景强化(BPE):双乳BPE欠对称,呈中度;
MR表现:
腺体:双乳腺体组织丰富,分布不均,动态增扫描呈多发斑片及小结节样持续强化灶,TIC呈上升型。
肿块:右乳上方见散在多发结节影,较大者位于右乳外伤区域,直径约12mm,病灶信号DWI扫描呈高信号,ADC图信号明显降低,时间-信号强度曲线(TIC)呈流出型;左乳乳晕后方及中下区域见有多发团块样及结节状异常信号影,较大者大小约42mm*31mm,病灶信号DWI扫描呈高信号,ADC图信号明显降低,动态增强扫描呈明显不均匀强化,较大病灶局部呈花环状强化,边缘部分不清,时间-信号强度曲线(TIC)呈流出型;
供血动脉:左侧供血血管明显增粗;
乳后间隙:清晰;
乳头:左乳头局部凹陷;乳晕:左乳晕局部增厚;皮肤:左乳皮肤局部牵拉改变;
乳腺导管:双乳部分导管轻度扩张。
腋窝:双侧腋下多枚淋巴结影。
附见:所见胸骨形态改变伴多发团片状异常信号影,DWI呈高信号,ADC信号减低,增强扫描呈不均匀强化。
结论:
左乳晕后方不规则肿块伴左乳内多发性病灶,考虑乳腺Ca伴乳内播散转移可能,建议穿刺活检;BI-RADS 4C
右乳上方多发结节,考虑转移可能;BI-RADS 4c。
双乳部分导管轻度扩张。
双侧腋下多枚淋巴结影。
附见:所见胸骨多发异常信号影,考虑转移。
胸部CT表现:两肺多发结节、纵隔及两肺门淋巴结肿大、胸骨骨质破坏伴软组织肿块形成、两侧多发肋骨及部分胸椎附件骨质破坏,部分病理性骨折。考虑转移。
病理报告:“左乳穿刺活检”乳腺浸润性导管癌Ⅱ级。
免疫组化:P53(5%+)、Ki-67(10%+)、ER(80% 3+)、PR(80%+ 3+)、AR(-)、HER-2(1+)、P63(-)、CK5/6(-)、CK14(-)、E-cad(+)、P120(膜+)、TRPS1(+)。
乳房穿刺活检病理:
“左腋下淋巴结”细针穿刺液基细胞学找到癌细胞。
“左锁骨上淋巴结”细针穿刺液基细胞学淋巴结转移性癌。
“右乳穿刺活检”乳腺浸润性导管癌Ⅱ级。
免疫组化:P53(个别+)、Ki-67(15%+)、ER(90%3+)、PR(10%1+)、AR(-)、HER-2(0)、P63(-)、CK5/6(-)、CK14(-)、E-cad(+)、P120(膜+)、TRPS1(+)、CD31(血管+)、D2-40(淋巴管+)。
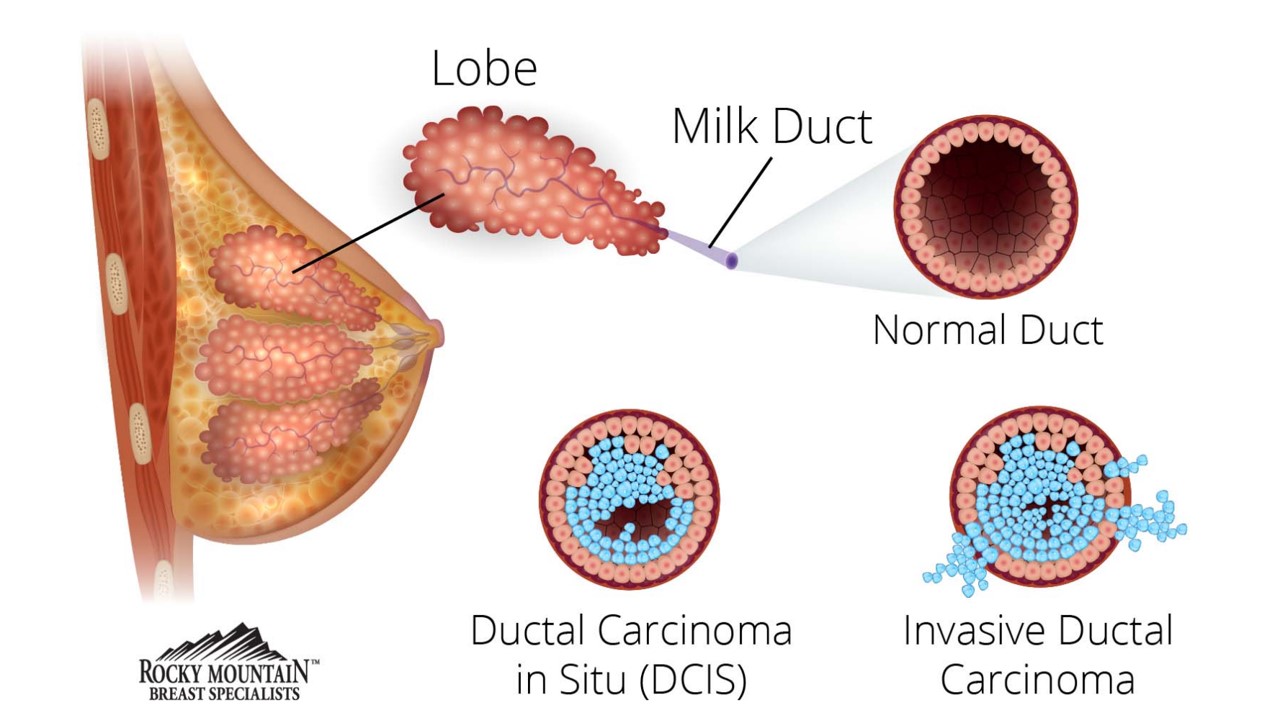
浸润性导管癌(invasive ductal carcinoma,IDC)是指癌变的导管上皮突破基底膜,浸润入间质组织,多由导管原位癌(ductal carcinoma in situ,DCIS)发展而来。IDC常以单一的形式出现,少数混有一个或多个其他组织学类型(肿瘤成分占比﹤10%),部分学者将其归为浸润性导管癌或非特殊型的浸润性癌(infiltrating ductal carcinoma,not otherwise special,NOS)并简单注明其他类型的存在,其他学者则将其归类为混合型。
IDC临床最常表现为可触及的肿物,多质硬且活动度差;通常无痛或仅有轻度疼痛,疼痛性质多为钝痛或隐痛,且局限于病变处,极少数病人以疼痛为首发症状;乳头溢液可见,多血性或浆液血性,多为单侧(本例双侧,少见)、单孔,伴肿块常见;偶见表现为乳头Paget病;当病变进入中晚期,可引起皮肤改变,包括局部水肿、增厚或肿块牵拉悬韧带后局部凹陷形成 “酒窝征”;亦可牵拉乳头造成乳头回缩;有时无明显临床症状,仅表现为乳腺X线摄影片异常。
病理上典型IDC的肿瘤间质纤维化明显,肉眼表现像硬癌,质地坚硬,有时硬如岩石,切面灰白色,带有光泽。某些主要由肿瘤细胞组成伴有少量的纤维间质反应的则肉眼为黄褐色,并且柔软。大多数浸润性导管癌为星芒状或毛刺状的不规则边缘,也有一部分表现为圆形、推进式边缘,另外有些肿瘤大体边界清楚。
浸润性导管癌的生长方式、细胞特征、核分裂、间质纤维增生程度、导管原位癌成分的多少及类型在镜下表现为高度的异质性。
在同一病例可以见到组织学特征的多样性。肿瘤细胞排列呈腺管状、巢状、条索状、各种大小的梁状,或者实性片状。某些病例有灶状坏死,也可以有广泛性坏死。在细胞学上,肿瘤细胞从接近正常乳腺上皮细胞到明显的细胞多形性和非典型性。核分裂从难以察觉到易见。有些病例间质纤维增生不明显或略有,而有些肿物显示突出的间质纤维化,肿瘤细胞仅为次要成分。一些浸润性导管癌没有可辨认的导管原位癌,而在另一些病例中,原位癌却是肿瘤的主要成分。镜下肿瘤边缘可呈浸润性生长、膨胀性生长、边界清楚或以各种情况混合出现。
目前实际应用中,最常用的是组织学分级中的Elston-Ellis分级法,根据腺管形成、核多形性和核分裂数目每项计分均以1~3分计分,总分3~5分为Ⅰ级(高分化)、6~7分为Ⅱ级(中分化)、8~9分为Ⅲ级(低分化)。
影像表现
钼靶:常形成肿块,密度较高,分叶状外观,星芒状边缘;肿块内部、边缘及邻近组织常见钙化,钙化的密度、形态及大小不均质,颗粒数﹥10枚,钙化范围≥3cm,可呈簇状分布、不规则形分布或从乳头向深部的V形分布;可无明确的肿块,表现为从一点发出的放射状影和局灶性收缩,或在实质的边缘扭曲,更容易在Ⅰ、Ⅱ级肿瘤中被发现;极少数情况下表现为片状或小灶状不对称致密,中心密度高,边缘模糊,常是乳腺癌的最早征象。
MRI:形成肿块,分叶状外观常见,边缘多不规则,星芒状或毛刺样;亦可呈楔形、段样或不规则形,边缘常不清;T1WI以等、低信号为主,T2WI以稍高信号为主,肿块样病变中央坏死常见;DWI多为高信号,可不均匀,ADC值明显降低;时间-信号强度动态曲线以Ⅱ型、Ⅲ型曲线为主,偶见Ⅰ型曲线;晚期可有胸肌、胸壁受侵,皮肤增厚,乳头凹陷,同侧腋下淋巴结肿大等。
总的来说,肿块型病灶的边界特征、非肿块型病灶的形态及分布特征、较低的ADC值和增强曲线的类型,可提供较多的诊断价值。
融合影像特征
致密肿块伴分叶状外观及星芒状边缘、局部结构扭曲或不对称致密;钙化常见,颗粒数﹥10枚,钙化范围≥3cm,且形态、密度、分布不均;血流增多,Ⅱ、Ⅲ型强化曲线;淋巴结转移出现较早。
鉴别诊断
当IDC病灶较小或呈现良性征象时,如单纯小范围钙化需与纤维囊性变鉴别;表现为小肿块且边界清晰光滑需与良性肿瘤如纤维腺瘤鉴别,特别是特殊类型的,如黏液性及腺性纤维瘤呈快速显著强化时,需综合判断;星芒状的边缘亦可见于放射状瘢痕、脂肪坏死、手术瘢痕等,需结合病史做出判断;脂肪坏死当其无明显外伤史,又发生在乳腺较深部与腺体重叠时,早期鉴别困难,随诊有帮助,因为脂肪坏死大多有缩小趋势,而且病变后期纤维化后强化曲线应为延迟强化,与恶性病变逐渐增大且快进快出的强化方式有明显区别;有些乳腺良性病变表现出恶性征象,如乳腺炎形成脓肿成熟期前可表现质硬肿块,壁不均匀或欠光整、外缘模糊、皮肤增厚、皮下脂肪层浑浊等征象,与恶性病变鉴别困难,可从病史、发病年龄、肿块硬度、血流情况、是否伴有钙化及钙化形态数目上加以鉴别,当脓肿成熟形成均匀厚壁时较易鉴别。
IDC少见表现为囊性为主时应与腺样囊性癌、囊内乳头状癌及脓肿鉴别。腺样囊性癌发病率极低,仅见于乳腺恶性肿瘤0.1%不到,常见于绝经后妇女,约半数位于乳晕后方,活动度较好,以实性成分为主,囊为多发微囊;囊内乳头状癌为导管内乳头状癌的一型,其囊性部分其实为囊状扩张的导管,肿瘤为实性部分,因肿瘤常有出血,含铁血黄素在囊内沉着,故密度常高于一般囊肿及纤维腺瘤,导管造影可见导管扩张、充盈缺损及分支导管受压移位,对鉴别诊断帮助较大;脓肿壁较厚且均匀,内壁多较光整,强化曲线为Ⅰ型或Ⅱ型。
小结
IDC是最常见的乳腺恶性肿瘤,它的影像学表现多有特征。当IDC表现为肿块时,超声常可根据其不规则的形状,星芒状的边缘,后方回声衰减,较硬的质地,及相对丰富的血流,在肿块较小时(﹤5mm)时即做出较准确的诊断,并可在早期即根据淋巴结门的形态改变提示转移可能;当IDC表现为单纯钙化时,乳腺X线摄影可根据钙化的形态、密度及分布情况做出诊断,颗粒数﹥10枚,钙化范围≥3cm时诊断较有把握;当肿块较大或伴有明显异型钙化时,超声及乳腺X线摄影均有典型征象;MRI对于较小的肿块及部分非肿块型的病变如单纯不对称致密等的诊断是一个有益的补充,因为它可全方位观察病灶形态、内部结构、边缘、血流、淋巴结等,甚至可以从分子水平分析病变的特征,造影剂的使用及多时期采集更可全面反映病灶特征及周边血流情况。
类型:原创
病例ID:ZYLM000004245
校对:王宇军
阅读:1135
文章已于2024-02-22修改






